Géométrie Moléculaire du Dichlorométhane
Comprendre la Géométrie Moléculaire du Dichlorométhane
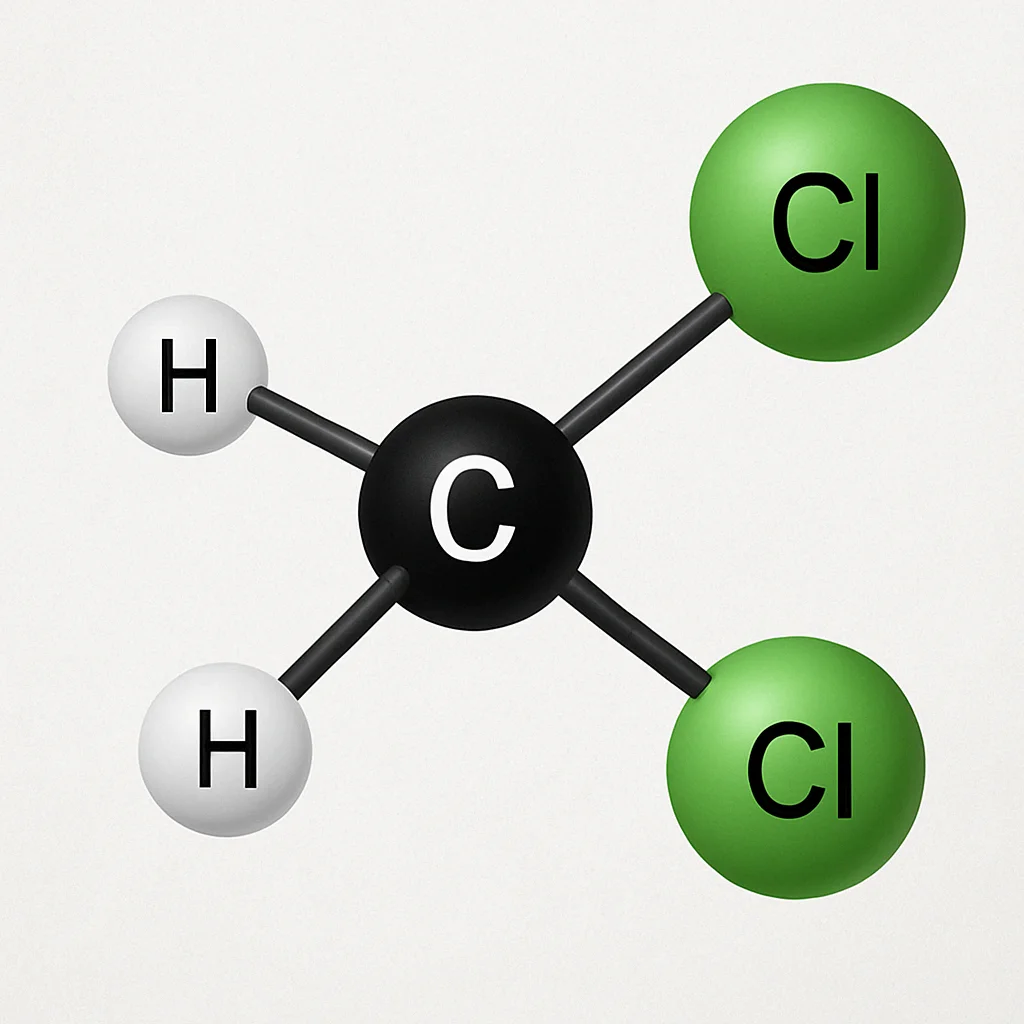
Le dichlorométhane est un solvant couramment utilisé en chimie organique. Sa formule moléculaire est CH2Cl2. Dans cet exercice, vous déterminerez la géométrie de la molécule de dichlorométhane en utilisant la théorie VSEPR.
Données:
- Le carbone (C) est l’atome central.
- La molécule comprend deux atomes d’hydrogène (H) et deux atomes de chlore (Cl).
- Le carbone forme quatre liaisons covalentes pour compléter sa couche de valence.
Questions:
- Dessinez la structure de Lewis de CH2Cl2. Combien d’électrons de valence sont présents dans la molécule ?
- Déterminez le nombre de paires d’électrons de liaison et de paires d’électrons libres autour de l’atome de carbone.
- Utilisez la théorie VSEPR pour prédire la géométrie moléculaire de CH2Cl2. Quel est l’angle de liaison théorique entre les atomes autour du carbone ?
- Expliquez comment les différences d’électronegativité entre le carbone, l’hydrogène et le chlore affectent la géométrie de la molécule.
Correction : Géométrie Moléculaire du Dichlorométhane
1. Structure de Lewis et nombre d’électrons de valence
Étape 1 : Calcul du nombre d’électrons de valence
Pour chaque atome, le nombre d’électrons de valence est le suivant :
- Carbone (C) : 4 électrons de valence.
- Hydrogène (H) : 1 électron de valence (pour chaque atome).
- Chlore (Cl) : 7 électrons de valence (pour chaque atome).
Calcul :
\[ \text{Total d'électrons de valence} = 4 \, (\text{C}) + 2 \times 1 \, (\text{H}) + 2 \times 7 \, (\text{Cl}) \] \[ \text{Total d'électrons de valence} = 4 + 2 + 14 \] \[ \text{Total d'électrons de valence} = 20 \, \text{électrons} \]
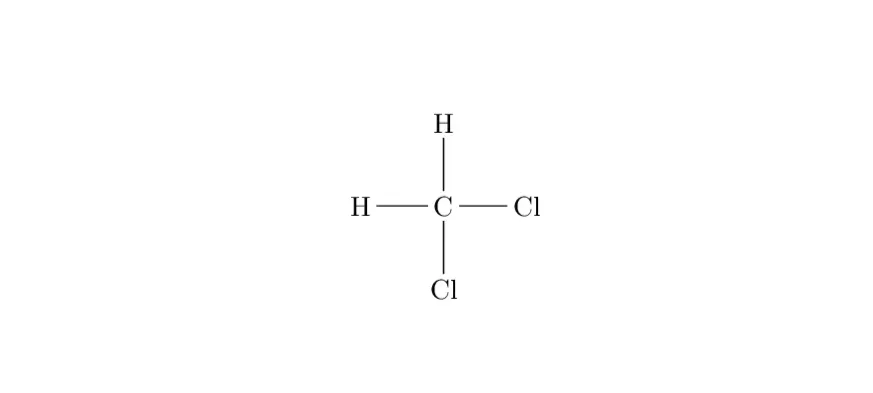
Étape 2 : Dessin de la structure de Lewis
Pour dessiner la structure, on place le carbone au centre et on le relie aux deux atomes d’hydrogène et aux deux atomes de chlore par des liaisons covalentes simples.
- Chaque liaison simple correspond à une paire d’électrons partagée.
- Après avoir placé les liaisons autour du carbone, on complète les octets pour les atomes périphériques en ajoutant des doublets non liants (notamment pour les chlorures).
Résultat :
- Carbone : 4 liaisons (aucun électron non liant).
- Hydrogène : Chaque atome atteint l’octet en partageant l’électron de C (pour H, c’est la règle du duet).
- Chlore : Chaque atome possède 3 paires non liantes et participe à une liaison covalente avec le carbone.
- La somme des électrons utilisés est de 4 liaisons × 2 électrons = 8 électrons dans les liaisons.
- Le reste (20 – 8 = 12) est réparti sous forme de paires non liantes sur les atomes de chlore (chaque Cl reçoit 3 paires = 6 électrons, et 2 × 6 = 12 électrons au total).
2 : Paires d’électrons autour du carbone
Analyse des domaines électroniques sur le carbone
- Paires d’électrons de liaison (liantes) : Le carbone forme 4 liaisons simples (avec 2 atomes d’hydrogène et 2 atomes de chlore) ce qui correspond à 4 paires d’électrons liantes.
- Paires d’électrons libres (non liantes) : Le carbone n’a aucune paire non liante.
Conclusion :
- Nombre total de domaines électroniques autour du C = 4 (4 liaisons, 0 non liantes).
3. Prédiction de la géométrie moléculaire
Application de la théorie VSEPR
- Avec 4 domaines électroniques et aucune paire non liante, l’arrangement optimal est la géométrie tétraédrique.
- L’angle de liaison théorique idéal dans une structure tétraédrique est d’environ 109,5°.
Résultat :
- Géométrie moléculaire de CH₂Cl₂ : tétraédrique.
- Angle de liaison théorique : ~109,5°.
4. Influence des différences d’électronegativité
Analyse des différences d’électronegativité
-
Différences entre atomes :
- Le chlore est beaucoup plus électronégatif que le carbone (valeur approchée sur l'échelle de Pauling : Cl ≈ 3,16, C ≈ 2,55).
- L’hydrogène, avec une électronégativité d’environ 2,20, est moins électronégatif que le chlore et aussi légèrement inférieur à celle du carbone.
-
Effets sur la répartition des électrons et la polarité :
- C–Cl : La différence d’électronégativité entraîne un décalage de la densité électronique vers le chlore, ce qui crée une polarisation importante au niveau de la liaison (le Cl partiellement négatif, le C partiellement positif dans ces liaisons).
- C–H : La différence d’électronégativité est moindre, rendant ces liaisons moins polaires.
Impact sur la géométrie moléculaire
- Disposition spatiale : Même si toutes les liaisons se disposent selon une géométrie tétraédrique pour minimiser la répulsion (comme le prédit VSEPR), la distribution inégale de la densité électronique induite par la polarité différente des liaisons peut provoquer de légères variations dans l’angle effectif par rapport à l’angle idéal.
- Moment dipolaire global : Le fait de ne pas avoir des substituants identiques (deux H et deux Cl) signifie que les moments dipolaires des liaisons ne s’annulent pas complètement, rendant la molécule globalement polaire malgré sa symétrie électronique tétraédrique.
Explication détaillée
- La poussée électrostatique générée par les liaisons C–Cl attire les électrons plus fortement vers le chlore.
- Ce déplacement électronique peut influencer la distribution de la densité dans l’espace autour de l’atome central, même si la structure électronique reste tétraédrique.
- Résultat : La polarisation des liaisons peut conduire à de petites déviations dans les angles observés expérimentalement par rapport à la valeur théorique de 109,5°, et contribue également au caractère globalement polaire de la molécule, ce qui affecte son comportement dans divers solvants.
D’autres exercice de chimie terminale:







0 commentaires