Géométrie Moléculaire du Dichlorométhane
Comprendre la Géométrie Moléculaire du Dichlorométhane
Le dichlorométhane est un solvant couramment utilisé en chimie organique. Sa formule moléculaire est CH2Cl2.
Dans cet exercice, vous déterminerez la géométrie de la molécule de dichlorométhane en utilisant la théorie VSEPR.
Données:
- Le carbone (C) est l’atome central.
- La molécule comprend deux atomes d’hydrogène (H) et deux atomes de chlore (Cl).
- Le carbone forme quatre liaisons covalentes pour compléter sa couche de valence.
Questions:
- Dessinez la structure de Lewis de CH2Cl2. Combien d’électrons de valence sont présents dans la molécule ?
- Déterminez le nombre de paires d’électrons de liaison et de paires d’électrons libres autour de l’atome de carbone.
- Utilisez la théorie VSEPR pour prédire la géométrie moléculaire de CH2Cl2. Quel est l’angle de liaison théorique entre les atomes autour du carbone ?
- Expliquez comment les différences d’électronegativité entre le carbone, l’hydrogène et le chlore affectent la géométrie de la molécule.
Correction : Géométrie Moléculaire du Dichlorométhane
1. Structure de Lewis de CH2Cl2
Étape 1: Calcul du nombre total d’électrons de valence
Le carbone (C) a 4 électrons de valence, chaque hydrogène (H) a 1 électron de valence, et chaque chlore (Cl) a 7 électrons de valence.
Ainsi, le nombre total d’électrons de valence dans CH2Cl2 est calculé comme suit:
\[ = 4 + 2 \times 1 + 2 \times 7 \] \[ = 4 + 2 + 14 \] \( = 20 \text{ électrons de valence.} \)
Étape 2: Dessin de la structure de Lewis
Pour CH2Cl2, le carbone est l’atome central car il a la plus grande capacité de former des liaisons multiples.
Les atomes d’hydrogène et de chlore se lient directement au carbone. En disposant les électrons pour minimiser la répulsion, on obtient quatre paires de liaison autour de l’atome de carbone, sans laisser de paires libres. Cela utilise tous les 20 électrons de valence.
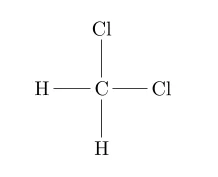
2. Nombre de Paires d’Électrons de Liaison et Libres
- Sur l’atome de carbone central, il y a 4 paires de liaison (deux liaisons C-H et deux liaisons C-Cl) et 0 paires libres, car tous les électrons de valence sont engagés dans des liaisons covalentes.
3. Géométrie Moléculaire Selon la Théorie VSEPR
- Détermination de la géométrie moléculaire
Selon la théorie VSEPR, une molécule avec quatre paires de liaison et aucune paire libre autour de l’atome central adopte une géométrie tétraédrique.
- Angle de liaison théorique
Dans une géométrie tétraédrique, l’angle entre les liaisons est d’environ 109.5°. Cela est dû à la répartition spatiale qui minimise la répulsion entre les paires d’électrons de liaison.
4. Influence des Différences d’Électronegativité
- Analyse des effets d’électronegativité
L’électronegativité mesure la capacité d’un atome à attirer les électrons vers lui dans une liaison chimique.
Le chlore étant plus électronégatif que le carbone et l’hydrogène, les liaisons C-Cl sont polarisées, avec une densité électronique plus élevée autour du chlore.
- Effet sur la géométrie moléculaire
Bien que les différences d’électronegativité entraînent une polarisation des liaisons C-Cl, elles ne modifient pas significativement la géométrie tétraédrique de la molécule de CH2Cl2.
La répartition spatiale reste optimisée pour minimiser la répulsion entre toutes les paires de liaison, maintenant ainsi l’angle de liaison proche de 109.5°.
Conclusion
La molécule de dichlorométhane (CH2Cl2) adopte une géométrie tétraédrique avec des angles de liaison d’environ 109.5°, conformément à la théorie VSEPR.
Cette géométrie est le résultat de la répartition de quatre paires de liaison autour de l’atome de carbone central, sans paires libres.
Les différences d’électronegativité entre le carbone, l’hydrogène et le chlore entraînent une polarisation des liaisons, mais ne changent pas la géométrie globale de la molécule.
Géométrie Moléculaire du Dichlorométhane
D’autres exercice de chimie terminale:




0 commentaires