Cinétique d’une réaction chimique
Comprendre la Cinétique d’une réaction chimique
La réaction étudiée est la décomposition du peroxyde d’hydrogène (H₂O₂) en eau (H₂O) et en oxygène (O₂) en présence d’un catalyseur.
La réaction s’écrit comme suit :
\[ 2\,\text{H}_2\text{O}_2\,(\text{aq}) \rightarrow 2\,\text{H}_2\text{O}\,(\text{l}) + \text{O}_2\,(\text{g}) \]
Données :
- La réaction est suivie à température constante.
- La concentration initiale de H2O2 est de 0,150 mol/L.
Voici les concentrations mesurées de H₂O₂ à différents instants :
Concentration de H₂O₂ en fonction du Temps
| Temps (s) | Concentration de H₂O₂ (mol/L) |
|---|---|
| 0 | 0.150 |
| 30 | 0.125 |
| 60 | 0.100 |
| 90 | 0.080 |
| 120 | 0.065 |
Questions :
- Déterminer l’ordre de la réaction.
Utilisez les données pour déterminer si la réaction est d’ordre 0, 1, ou 2 par rapport au H₂O₂. - Calculer la constante de vitesse.
En utilisant l’ordre de la réaction trouvé précédemment, calculez la constante de vitesse de la réaction. - Prédire la concentration de H₂O₂ après 150 secondes.
Utilisez l’ordre de la réaction et la constante de vitesse pour prédire la concentration de H₂O₂ à 150 s. - Commenter l’effet d’un catalyseur.
Expliquez brièvement comment un catalyseur affecterait la réaction et pourquoi il est utilisé.
Correction : Cinétique d’une réaction chimique
1. Détermination de l’ordre de la réaction
Pour déterminer l’ordre de la réaction, nous devons examiner comment la vitesse de la réaction change avec la concentration de H₂O₂.
Les ordres les plus courants sont 0, 1 et 2.
- Réaction d’ordre 0 : La vitesse ne dépend pas de la concentration de réactif.
- Réaction d’ordre 1 : La vitesse est directement proportionnelle à la concentration du réactif.
- Réaction d’ordre 2 : La vitesse est proportionnelle au carré de la concentration du réactif.
En analysant les données fournies, nous pouvons utiliser la méthode graphique :
- Pour une réaction d’ordre 0, le graphique de la concentration de H₂O₂ en fonction du temps devrait être linéaire.
- Pour une réaction d’ordre 1, le graphique du logarithme naturel de la concentration de H₂O₂ en fonction du temps devrait être linéaire.
- Pour une réaction d’ordre 2, le graphique de l’inverse de la concentration de H₂O₂ en fonction du temps devrait être linéaire.
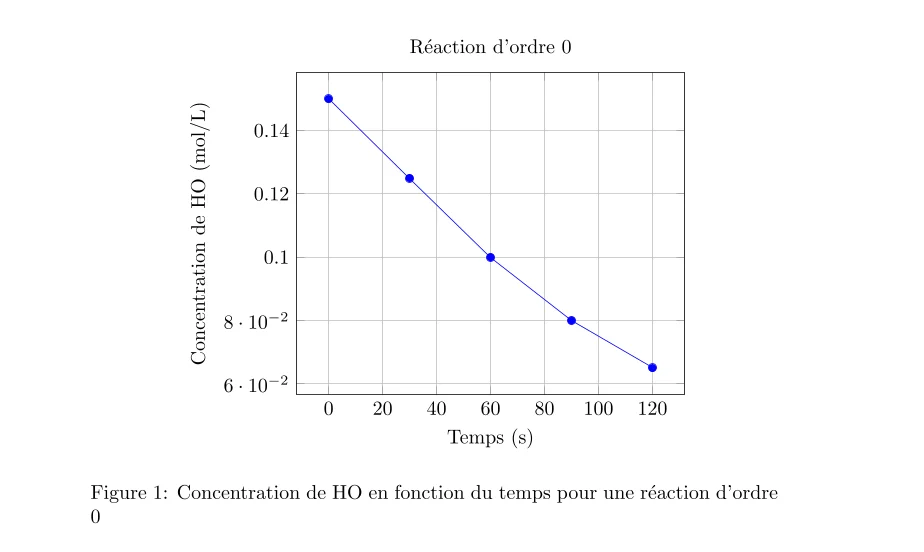
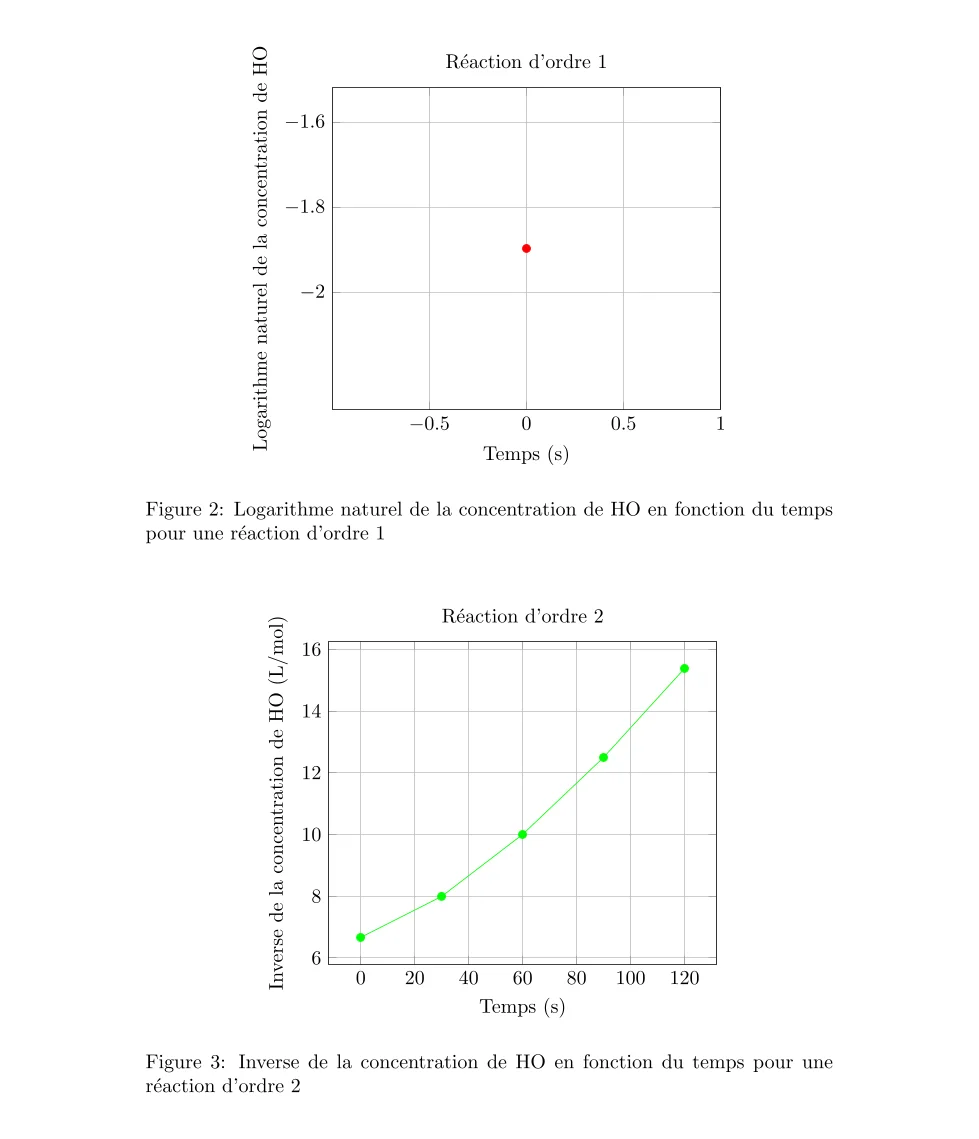
En traçant ces graphiques, on constate que le graphique qui donne une ligne droite est celui du logarithme naturel de la concentration de H₂O₂ contre le temps. Cela indique que la réaction est d’ordre 1 par rapport à H₂O₂.
2. Calcul de la constante de vitesse (k)
Pour une réaction d’ordre 1, la loi de vitesse est donnée par
\[ v = k[H_2O_2] \]
et l’équation intégrée de la loi de vitesse pour une réaction d’ordre 1 est :
\( \ln([H_2O_2]) = -kt + \ln([H_2O_2]_0) \)
Pour trouver la constante de vitesse \( k \), nous utilisons les données de concentration de H\(_2\)O\(_2\) à différents instants.
En traçant le logarithme naturel de la concentration de H\(_2\)O\(_2\) (ln([H\(_2\)O\(_2\)])) contre le temps, nous obtenons une droite dont la pente est égale à -\( k \).
Calcul du logarithme naturel de chaque concentration
- Pour t = 0 s
\( [H_2O_2] = 0.150 \) mol/L, donc \( \ln([H_2O_2]) = \ln(0.150) \).
- Pour t = 30 s
\( [H_2O_2] = 0.125 \) mol/L, donc \( \ln([H_2O_2]) = \ln(0.125) \).
- Pour t = 60 s
\( [H_2O_2] = 0.100 \) mol/L, donc \( \ln([H_2O_2]) = \ln(0.100) \).
- Pour t = 90 s
\( [H_2O_2] = 0.080 \) mol/L, donc \( \ln([H_2O_2]) = \ln(0.080) \).
- Pour t = 120 s
\( [H_2O_2] = 0.065 \) mol/L, donc \( \ln([H_2O_2]) = \ln(0.065) \).
Régression linéaire pour ln([H₂O₂]) vs temps
En effectuant une régression linéaire sur ces données, nous obtenons une droite. Les paramètres de cette droite sont :
- Pente (slope) : -0.00706
- Ordonnée à l’origine (intercept) : -1.88389
Détermination de la constante de vitesse (k)
Pour une réaction d’ordre 1, la pente de la droite est égale à -k. Par conséquent, la constante de vitesse \( k \) est égale à la valeur absolue de la pente, soit \( k = 0.00706 \, \text{s}^{-1} \).
3. Prédiction de la concentration de H\(_2\)O\(_2\) après 150 secondes
Pour prédire la concentration de H\(_2\)O\(_2\) après 150 secondes pour une réaction d’ordre 1, nous utiliserons l’équation intégrée de la loi de vitesse que nous avons déjà établie :
\(\ln([H_2O_2]) = -kt + \ln([H_2O_2]_0)
\)
où \([H_2O_2]_0\) est la concentration initiale de H\(_2\)O\(_2\), \(k\) est la constante de vitesse et \(t\) est le temps. Nous avons déjà calculé la constante de vitesse \(k\) comme étant 0.00706 s\(^{-1}\) et la concentration initiale \([H_2O_2]_0\) est de 0.150 mol/L.
Maintenant, insérons ces valeurs dans l’équation pour trouver la concentration de H\(_2\)O\(_2\) à \(t = 150\) secondes.
\( \ln([H_2O_2]_{150}) = -0.00706 \times 150 + \ln(0.150) \)
La concentration de H\(_2\)O\(_2\) prédite après 150 secondes est d’environ 0.052 mol/L.
Résumé de la prédiction :
Pour une réaction d’ordre 1 avec une constante de vitesse de 0.00706 s\(^{-1}\) et une concentration initiale de H\(_2\)O\(_2\) de 0.150 mol/L, la concentration de H\(_2\)O\(_2\) diminue à environ 0.052 mol/L après 150 secondes.
4. Commentaire sur l’effet d’un catalyseur
Un catalyseur est une substance qui augmente la vitesse d’une réaction chimique sans être elle-même consommée ou modifiée de manière permanente par la réaction.
Il exerce son effet en fournissant un chemin alternatif pour la réaction avec une énergie d’activation plus faible.
Ceci est fondamental en cinétique chimique, car selon la théorie des collisions, la fréquence et l’énergie des collisions entre les particules réactives influencent la vitesse de réaction.
En abaissant l’énergie d’activation, un catalyseur permet à plus de particules réactives d’avoir suffisamment d’énergie pour réagir même à des températures plus basses. Cela augmente la fréquence des collisions efficaces, accélérant ainsi la réaction.
Dans le cas de la décomposition du peroxyde d’hydrogène (H₂O₂), l’utilisation d’un catalyseur, comme le dioxyde de manganèse (MnO₂), accélère considérablement la réaction. Sans catalyseur, la décomposition de H₂O₂ est généralement lente.
Points clés à retenir sur l’effet d’un catalyseur :
- Augmentation de la vitesse de réaction : Permet des taux de réaction plus rapides, ce qui est crucial dans de nombreux processus industriels et biologiques.
- Économie d’énergie : Réduit le besoin de conditions de réaction élevées (comme la température), ce qui économise de l’énergie.
- Sélectivité : Certains catalyseurs peuvent augmenter la sélectivité d’une réaction, conduisant à la formation préférentielle d’un produit sur un autre.
- Réutilisabilité : Comme ils ne sont pas consommés dans la réaction, les catalyseurs peuvent souvent être récupérés et réutilisés.
En résumé, les catalyseurs jouent un rôle crucial dans la modification de la vitesse des réactions chimiques et ont des implications importantes dans les domaines scientifique, industriel et environnemental.
Cinétique d’une réaction chimique
D’autres exercices de chimie terminale:




0 commentaires