Structure de l’Atome
Comprendre la Structure de l’Atome
Un atome est la plus petite unité constitutive de la matière qui conserve les propriétés chimiques d’un élément. Les atomes sont composés de trois types de particules subatomiques : les protons, les neutrons et les électrons.
Consignes
- Identification des Particules Subatomiques
- Un atome de bore (B) a un nombre atomique de 5 et une masse atomique de 11. Combien de protons, de neutrons et d’électrons contient-il ?
- Isotopes
- Définissez ce qu’est un isotope.
- Donnez un exemple d’isotope du carbone et expliquez en quoi il diffère du carbone-12.
- Configuration Électronique
- Déterminez la configuration électronique de l’atome de bore.
- Dessinez un schéma de l’atome de bore montrant la répartition de ses électrons dans les différentes couches électroniques.
Questions Bonus
- Pourquoi les atomes sont-ils électriquement neutres ?
- Qu’arrive-t-il à un atome lorsqu’il gagne ou perd des électrons ?
Correction : Structure de l’Atome
1. Identification des Particules Subatomiques
Un atome de bore (B) a un nombre atomique de 5 et une masse atomique de 11.
- Nombre de protons :
Le nombre atomique indique le nombre de protons. Donc, l’atome de bore a 5 protons.
- Nombre de neutrons :
La masse atomique est la somme des protons et des neutrons. Donc, le nombre de neutrons = masse atomique – nombre atomique = 11 – 5 = 6 neutrons.
- Nombre d’électrons :
Dans un atome neutre, le nombre d’électrons est égal au nombre de protons. Donc, l’atome de bore a également 5 électrons.
2. Isotopes
- Définition d’un isotope :
Un isotope est une variante d’un élément chimique qui a le même nombre de protons mais un nombre différent de neutrons.
Ainsi, bien que les isotopes aient des propriétés chimiques similaires, ils ont des masses différentes.
- Exemple d’isotope du carbone :
Le Carbone-14 (C-14) est un isotope du carbone. Alors que le carbone-12 (la forme la plus courante du carbone) a 6 neutrons, le carbone-14 en a 8.
Cela change sa masse atomique mais pas son comportement chimique.
3. Configuration Électronique
Configuration électronique du bore :
- Le bore a 5 électrons. La première couche électronique (couche K) peut contenir jusqu’à 2 électrons, et la seconde couche (couche L) jusqu’à 8.
- Donc, la configuration électronique du bore est 1s² 2s² 2p¹, signifiant que les deux premiers électrons remplissent la première couche (1s²), les deux suivants la sous-couche 2s de la deuxième couche, et le dernier se place dans la sous-couche 2p.
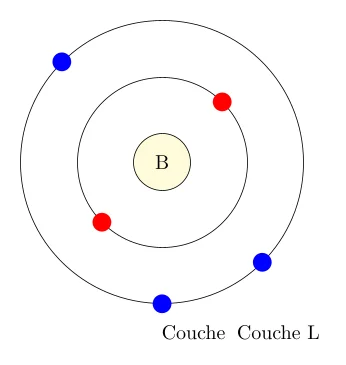
Schéma :
- La première couche (K) contient 2 électrons.
- La deuxième couche (L) contient 3 électrons.
Questions Bonus
Neutralité électrique des atomes :
Les atomes sont électriquement neutres parce qu’ils possèdent un nombre égal de protons (charge positive) et d’électrons (charge négative).
Les charges opposées s’annulent mutuellement, résultant en une charge nette de zéro.
Gain ou perte d’électrons :
Gain d’électrons : Lorsqu’un atome gagne un ou plusieurs électrons, il acquiert une charge négative et devient un ion négatif (anion).
Perte d’électrons : Lorsqu’un atome perd un ou plusieurs électrons, il acquiert une charge positive et devient un ion positif (cation).
Structure de l’Atome
D’autres exercices de chimie 3 ème:




0 commentaires